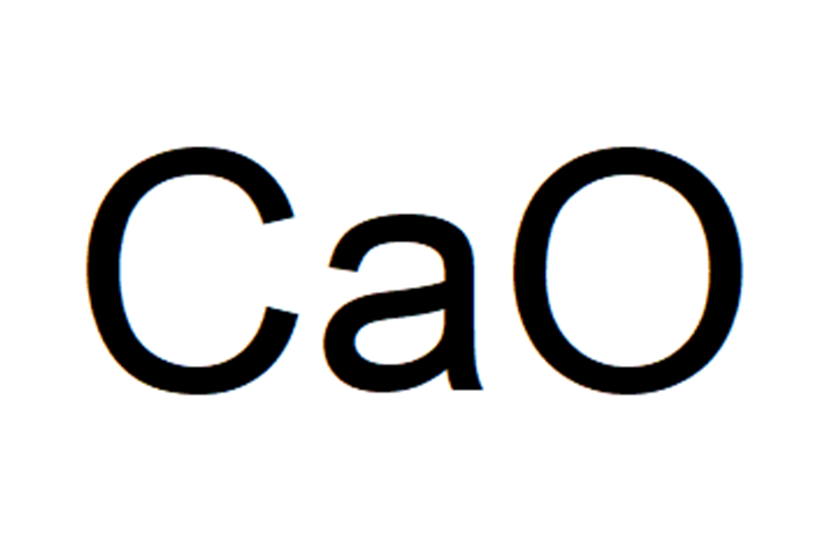水酸化カルシウム(すいさんかカルシウム、英: Calcium hydroxide)は、化学式 Ca(OH)2 で表されるカルシウムの水酸化物。消石灰(しょうせっかい)とも呼ばれる。固体はカルシウムイオンと水酸化物イオンからなるイオン結晶である。水溶液は石灰水、懸濁液は石灰乳と呼ばれ、共に強いアルカリ性を示す。石灰水は二酸化炭素を簡易的に検出する試薬として多用されている。小・中学校の理科の授業でも使用されている。
天然には、ポートランダイト(ポートランド石ともいうが、同名の岩石とは異なる)として産出する。
生産
酸化カルシウムに加水すると生成する。その水和熱は大きく、乾燥剤としてよく用いられる酸化カルシウム(生石灰)に水を加えることは危険である。
消石灰の2016年度日本国内生産量は 1,342,058 t、消費量は 517,767 t である。
ほたての貝殻を焼成・粉砕した焼成カルシウム、またはそれに加水したものを「ほたてカルシウム(貝殻焼成カルシウム)」の名称で販売している商品もある。
用途
水酸化カルシウムは、強塩基であるが劇物指定を受けていないため、酸性化した河川や土壌の中和剤、凝集剤として幅広く使われる。ほかに、試薬・農業・食品や化粧品のpH調整剤、カルシウム補充剤、化学合成原料、体質顔料、殺菌剤、歯科治療における感染根管処置時の貼薬剤などとしても用いられる。コンニャクの凝固剤としても使用されている。また、火力発電所の排ガス中の硫黄酸化物の除去にも用いられる。漆喰は水酸化カルシウムを主成分とする建築材料である。
強塩基であることから、微生物の繁殖を抑制したり不活性化したりする性質がある。中世ヨーロッパでは、ペストの流行時に消石灰を家に撒く対策が行われた。現代でも、高病原性鳥インフルエンザや豚熱などの防疫のため、消石灰が利用されている。
小中学校などでは校庭に白線を引くラインパウダーとして用いられていた。他方、強塩基であるため、目に入ると失明する危険性があることから、2007年11月に文部科学省スポーツ・青少年局学校健康教育課長名で通達が出されたこともあり、白線用としては、より安全な炭酸カルシウムに変更されている。
反応
水溶液の性質
水酸化カルシウムは水に少量溶解して塩基性を示し、飽和溶液の電離度が0.8程度と高いために強塩基として分類されるが、溶解度はアルカリ金属などの水酸化物よりはるかに低く、塩基としての作用はこれらより弱い。その溶解度積は以下の通りで、飽和水溶液はpH=12.4である。
- ,
また、水に対する溶解熱が発熱的であるため、溶解度は温度の上昇と伴に減少する。
- ,
水酸化カルシウムを酸で中和したものであるカルシウム塩水溶液はごくわずかに加水分解するが、ほとんど無視し得る。その酸解離定数は以下の通りである。
- ,
したがって、水酸化カルシウムの第二段階塩基解離定数は以下のようになる。
- ,
二酸化炭素との反応・変化
水酸化カルシウムが飽和した水溶液は石灰水 (Lime water) と呼ばれ、二酸化炭素を吹き込むと炭酸カルシウムが析出し、白く濁る。これは生成する炭酸カルシウムが水に難溶性であるためである。
さらに、過剰に二酸化炭素を吹き込むと、炭酸カルシウムと二酸化炭素と水の結合により、炭酸水素カルシウム(Ca(HCO3)2)が生成される。炭酸水素カルシウムは水に溶解するので濁りも消えるが、以下の平衡定数の関係上、2倍程度に薄めた石灰水でないと濁りは完全に消えない。
アンモニア発生実験
実験室でアンモニアを発生させるとき、強塩基かつ不揮発性の水酸化カルシウムと塩化アンモニウムを混合して加熱する。
中和反応
水酸化カルシウムは塩基であるため、酸と中和反応を起こす。たとえば、塩酸と反応して水と塩化カルシウムを生成する。
人体への影響
水溶液はアルカリ性を示すため、粘膜・皮膚を侵す。特に目に入った場合は角膜・結膜に障害を起こすことがあるので、速やかに流水で十分に洗眼し、緊急に眼科医の診察を受けるべきである。
胃に入った場合は胃液で中和されるために人体への影響は少ないが、多量に摂取すると下記のような健康への影響がありうる。
- 呼吸困難
- 内出血
- 血圧上昇
- 腎機能障害
- 肝機能障害
脚注
関連項目
- 酸化カルシウム(生石灰)
- 炭酸カルシウム
- 石灰
- 石灰岩
外部リンク
- 水酸化カルシウム 理科ねっとわーく(一般公開版) - ウェイバックマシン(2017年10月2日アーカイブ分) - 文部科学省 国立教育政策研究所
- 石灰水 理科ねっとわーく(一般公開版) - ウェイバックマシン(2017年10月2日アーカイブ分) - 文部科学省 国立教育政策研究所